知识点总结
1、“相似相溶”规律: 非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
2、范德华力的认识:很弱,约比化学键能小1~2个数量级。相对分子质量越大,范德华力越大,分子的极性越大,范德华力越大,物质的熔点、沸点越高、硬度越大。
3、氢键的认识: 由已经与电负性很强的原子(一般指氮、氧、氟)形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力。大小介于范德华力和化学键之间,约为化学键的十分之几。
常见考法
1、分子间作用力与化学键的比较:分子间作用力,与化学键相比,是一种较弱的作用力。
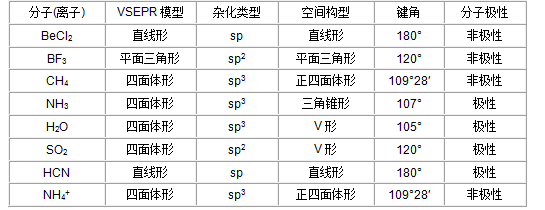
2、判断分子空间构型;中心原子杂化类型;判断分子极性:
①确定中心原子价电子层中价电子对数,一般价电子对数=δ键的数目+孤对电子对数;
②价电子对数为4、3、2时,VSEPR模型分别是四面体形、平面三角形、直线形;
③中心原子杂化轨道数=中心原子所连原子数+孤对电子对数;
④分子的正电中心和负电中心是否重合,判断分子的极性。
误区提醒
【典型例题】
例析:下列说法正确的是( )
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、只有非金属原子间才能形成共价键
解析:
离子化合物一定有离子键,可以有共价键;共价化合物只能有共价键。由共价键形成的分子,可以是化合物,也可以是单质;共价键与离子键的区别是成键原子电负性的差值,金属与非金属原子间也可以形成共价键,如AlCl3。
答案:B






